2024年7月份中美欧批准上市新药盘点:又一阿尔茨海默病新药在美获批
- 2024-08-23 23:50
- 作者:陈倩
- 来源:中国医药报
2024年7月中美欧批准上市的新药中,有两款“全球新”药物在美国获批上市。
其中,礼来研发的新一代抗β淀粉样蛋白(Aβ)单抗Donanemab成功获批,用于治疗阿尔茨海默病,这是全球第一款也是唯一一款淀粉样斑块靶向疗法。
值得一提的是,基石药业自主研发的抗PD-L1单克隆抗体——舒格利单抗在欧盟获批上市,基石药业由此成为首个将国产PD-L1单抗推向国际市场的创新生物药企。
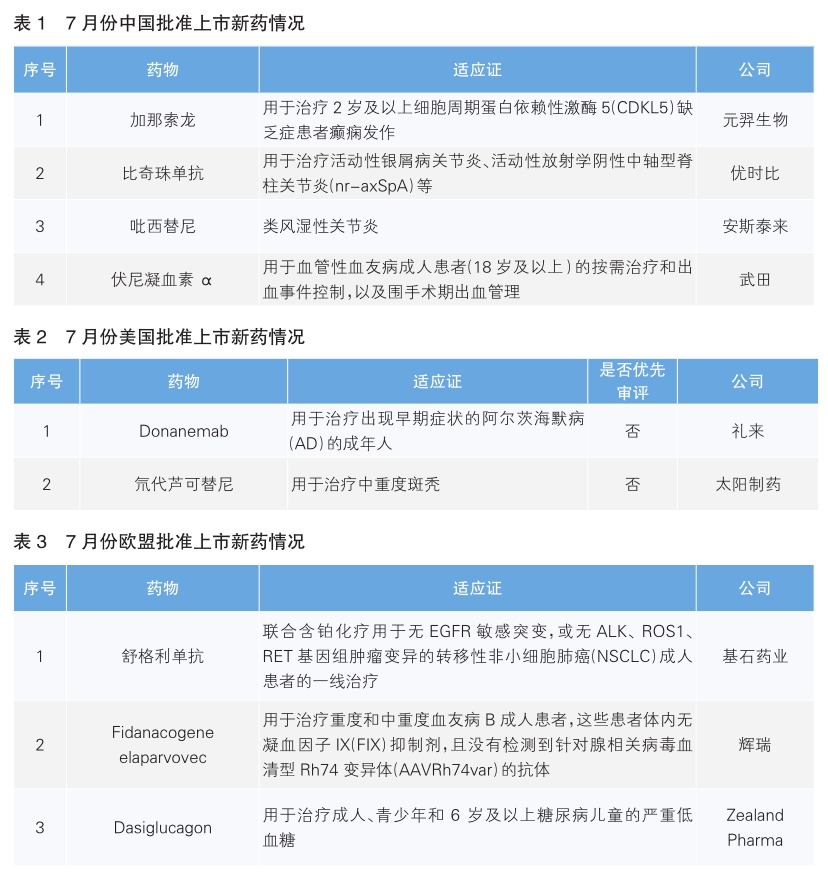
中国批准四款新药上市
7月份,我国批准了4款新药上市(详见表1)。根据Pharmadigger数据库,这4款新药均非全球首次获批新药。
加那索龙(商品名:泽元安)是Marinus公司开发的一款靶向GABAA(γ-氨基丁酸A型)受体的阳性变构调节剂,具有静脉注射和口服两种给药方式。GABA(γ-氨基丁酸)是中枢神经抑制性神经递质之一,与焦虑、紧张、抑郁等情绪变化有关。加奈索酮作用于神经元突触和突触外GABAA受体,从而达到抗癫痫和抗焦虑活性的效用。2022年11月,元羿生物与Marinus公司达成合作,获得在中国开发和商业化加奈索酮某些制剂的独家权利。加那索龙已于2022年3月获美国食品药品管理局(FDA)批准上市,其获批是基于一项随机、双盲、安慰剂对照Ⅲ期临床试验结果。结果显示,在治疗第28天时,加奈索酮组患者的主要运动性癫痫发作频率中位数减少了30.7%,显著优于安慰剂组。
比奇珠单抗(商品名:倍捷乐)是优时比研发的一款白介素-17A/F(IL-17A/F)抑制剂。IL-17A在斑块状银屑病、银屑病关节炎和强直性脊柱炎的发病机理中起关键作用。IL-17A与IL-17F具有大于50%的结构同源性和重叠的生物学功能,两者在多种发炎的人体组织中均上调,并与其他促炎细胞因子例如肿瘤坏死因子(TNF)协同作用,放大炎症反应。该药本次获批基于名为BE MOBILE 1和2的临床研究,结果显示,患者使用比奇珠单抗52周后,有60%的患者达到了显著的病情缓解标准。比奇珠单抗已于2021年8月在欧盟获批上市。
吡西替尼是安斯泰来研发的一种口服JAK抑制剂。类风湿性关节炎是一种慢性进行性的自身免疫性疾病,可引发一系列症状,包括关节部位的疼痛和肿胀,尤其是手、足和膝关节部位。JAK家族是一类非受体酪氨酸激酶,它们在多种Ⅰ型和Ⅱ型细胞因子受体的信号级联中具有重要的作用,由JAK介导的信号通路与细胞增殖、分化、凋亡以及炎症等过程有关。该药本次获批基于一项在中国进行的Ⅲ期临床试验,结果显示,患者使用吡西替尼第24周时,ACR20反应率(美国风湿病学会评估类风湿关节炎改善的一项复合指标)显著优于安慰剂组。吡西替尼此前已于2019年3月在日本获批上市。
伏尼凝血素α是武田研发的一款重组血管性血友病因子,半衰期长,可有效实现血管性血友病的替代治疗。血管性血友病是常见遗传性出血性疾病之一,主要是由于血管性血友病因子(vWF)基因突变,引起血浆中的vWF数量减少或质量异常。当vWF发生功能障碍或缺乏时,血液无法有效凝固,患者会出现不同程度的出血表现,严重者可发生内脏出血。一项注射用伏尼凝血素α治疗重度血管性血友病成人患者(18岁及以上)的Ⅲ期临床试验结果显示,在所有注射用伏尼凝血素α联用或不联用重组凝血因子FⅧ的受试者中,出血事件均得到有效控制。伏尼凝血素α此前于2015年12月在美国获批上市。
美国批准两款新药上市
7月份,美国批准上市2款新药(详见表2)。根据Pharmadigger数据库,这2款药均为全球范围内首次获批的新药。
Donanemab(商品名:Kisunla)是礼来研发的一款靶向β淀粉样蛋白(Aβ)的单克隆抗体,它能与名为N3pG的淀粉样蛋白亚型特异性结合。通过靶向这一亚型,Donanemab能够特异性地与大脑中的淀粉样斑块相结合,从而促进淀粉样斑块的清除,成为首个有证据表明在淀粉样斑块清除后可停止治疗的淀粉样斑块靶向疗法。阿尔茨海默病(AD)是一种以进行性认知障碍和行为损害为特征的中枢神经退行性疾病。该病的主要临床表现为严重的认知功能减退、进行性记忆丧失、逆行性和顺行性健忘, 并伴有严重的组织病理学改变,如海马体退化甚至丧失。AD具体病因尚未完全阐明,但其病理特征显示,AD患者的大脑出现Aβ斑块沉积。该药此次获批是基于临床试验TRAILBLAZER-ALZ 2的结果。结果显示,Donanemab可显著减缓具有AD早期症状患者的认知与功能下降,延缓疾病进展,并且患者淀粉样斑块显著减少。
氘代芦可替尼(Deuruxolitinib,商品名:Leqselvi)是Concert制药开发的一款口服JAK1/JAK2抑制剂,通过氘代化学技术修饰芦可替尼而来。2023年3月,印度头部药企太阳制药以5.76亿美元的总交易额收购Concer t制药,也获得该产品的所有权益。斑秃是一种由于免疫系统攻击毛囊而导致头皮和身体上的毛发部分或完全脱落的自身免疫性疾病。通常来说,头皮是斑秃影响较为常见且严重的部位,许多患者也因此承受巨大的心理压力。FDA本次批准该药主要是基于两项Ⅲ期临床研究THRIVEAA1和THRIVE-AA2的积极数据。结果显示,氘代芦可替尼组在头皮银屑病的整体临床评估(ss-PGA)以及头皮皮损面积和严重程度指数(PSSI)的改善方面,均显著优于安慰剂组。
欧盟批准三款新药上市
7月份,欧盟批准了3款新药上市(详见表3)。根据Pharmadigger数据库,这3款新药均非全球首次批准上市的新药。
舒格利单抗(商品名:Cejemly)是基石药业研发的全球首个在欧洲上市的、联合化疗一线治疗鳞状和非鳞状非小细胞肺癌(NSCLC)的PD-L1单抗。该药本次获批主要是基于一项多中心、随机、双盲的Ⅲ期临床研究GEMSTONE-302的结果。结果显示,舒格利单抗联合化疗对比安慰剂联合化疗,可显著延长初治转移性NSCLC患者的无进展生存期和总生存期。舒格利单抗最早于2021年在中国获批上市,目前已在中国获批5个适应证,分别是Ⅳ期NSCLC、Ⅲ期NSCLC、胃及胃食管结合部腺癌、食管鳞癌以及结外NK/T细胞淋巴瘤。
Fidanacogeneel aparvovec(商品名为Durveqtix)是辉瑞研发的一次性基因疗法,含有生物工程化的腺相关病毒衣壳和编码高活性FIX变体的转基因。该药本次获批基于一项正在进行的单臂、开放标签Ⅲ期临床试验的结果。该试验纳入了45名患有中度或重度血友病B的成年男性患者,他们的AAVRh74var中和抗体检测呈阴性,并接受了单次静脉输注Durveqtix,结果显示,Durveqtix显著降低了出血频率。该药此前已于今年4月在美国获批上市。
Dasiglucagon(商品名:Zegalogue)是诺和诺德研发的胰高血糖素的合成类似物,属于一种胰高血糖素受体激动剂,其作用是使肝脏将储存的糖原释放到血液中。2022年,生物技术公司Zealand Pharma与诺和诺德就Dasiglucagon达成全球许可和开发协议。Dasiglucagon此前已于2021年3月获美国FDA批准上市。(陈倩)
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:周雨同)
分享至
右键点击另存二维码!
-
为你推荐