2024年6月份中美欧批准上市新药盘点:六款“全球新”药物在中国获批
- 2024-07-18 10:41
- 作者:陈倩
- 来源:中国医药报
2024年6月中美欧批准上市的新药中,有8款为全球首次获批上市的新药。其中,中国批准上市6款“全球新”药物,均为中国药企自主研发;和黄医药自主研发的新药呋喹替尼在欧盟获批。
中国批准十一款新药上市
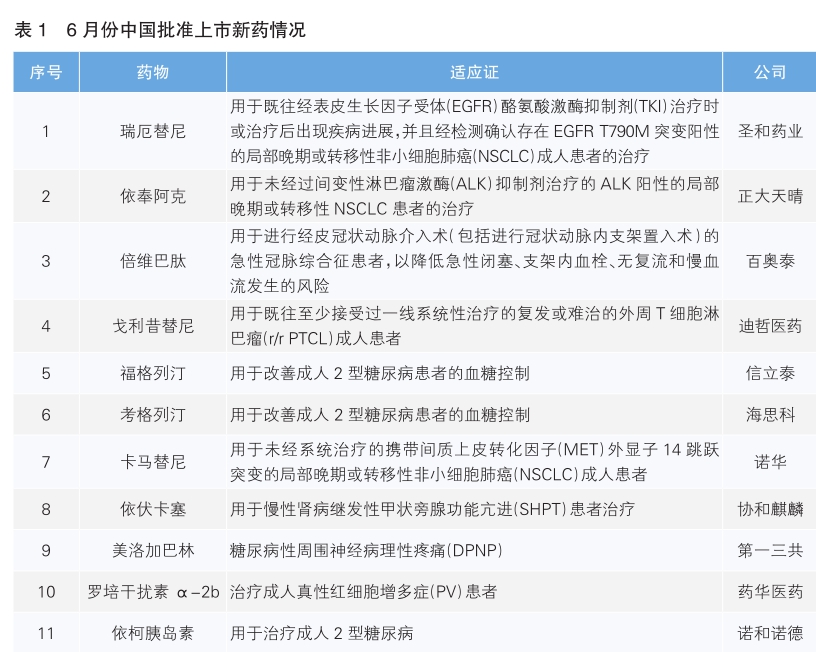
6月份,我国批准了11款新药上市。根据Pharmadigger数据库,其中全球首次获批的新药有6款,均为中国药企自主研发,包括两款治疗非小细胞肺癌(NSCLC)新药瑞厄替尼和依奉阿克,一款抗血栓药倍维巴肽,一款治疗外周T细胞淋巴瘤(r/r PTCL)新药戈利昔替尼,以及两款2型糖尿病新药福格列汀和考格列汀。
甲磺酸瑞厄替尼片(商品名:圣瑞沙)是南京圣和药业研发的第三代EGFR激酶抑制剂,可以不可逆地结合于突变形式的EGFR(T790M、L858R和19外显子缺失),抑制EGFR的磷酸化过程,阻断下游信号通路的激活。临床前的体内外研究均表明瑞厄替尼对野生型EGFR激酶具有较高的选择性。该药获批基于与标准治疗吉非替尼对比的一项Ⅲ期临床研究,结果显示,瑞厄替尼治疗组患者的中位无进展生存期(mPFS)相比于吉非替尼组提升了9.5个月。
枸橼酸依奉阿克胶囊(商品名:安洛晴)是正大天晴与首药控股联合开发的c-Met/ALK/ ROS多靶点酪氨酸激酶抑制剂。ALK阳性NSCLC患者约占全部NSCLC患者的3%~7%,这类患者中有多达40%在确诊时伴有脑转移。ALK突变有很强的排他性,当它突变时,其他驱动基因往往不会发生变异。该药获批基于与克唑替尼对比的一项Ⅲ期临床研究,结果显示,依奉阿克组的mPFS相对于克唑替尼提升了约13个月。
枸橼酸倍维巴肽注射液(商品名:贝塔宁)是百奥泰生物研发的一款肽类的血小板GPⅡb/Ⅲa受体拮抗剂,通过阻止纤维蛋白原、Von Willebrand因子和其它粘附配体与血小板GPⅡb/Ⅲa受体结合,抑制血小板的聚集。急性冠状动脉综合征是冠心病(PCI)的一种严重类型,表现为胸痛、胸闷等症状,可导致心律失常、心力衰竭甚至猝死,严重影响生活质量和寿命。该药获批基于一项Ⅲ期临床研究,结果显示,在PCI术后30天的死亡、心肌梗死、急性靶血管血运重建,包括急性闭塞、无复流或其他类似PCI并发症的抗血栓治疗的需求以及无复流和严重的慢血流的复合终点,倍维巴肽组优于对照组(标准治疗)。
戈利昔替尼(商品名:高瑞哲)是迪哲医药研发的一种JAK1抑制剂,可通过阻断JAK/STAT(Janus激酶/信号传导及转录激活蛋白)通路,抑制肿瘤细胞中STAT3磷酸化及相应信号传导,从而抑制肿瘤细胞增殖。外周T细胞淋巴瘤(PTCL)是一种起源于胸腺后成熟T/NK细胞的恶性肿瘤,在所有非霍奇金淋巴瘤中,PTCL患者生存率最低。一线治疗后缓解的PTCL患者存在极高复发风险,复发或难治PTCL患者的生存预后极差。该药获批是基于名为JACKPOT8 Part B的Ⅲ期临床研究,结果显示,戈利昔替尼单药治疗PTCL,有约44%的患者达到客观缓解,24%的患者获得完全缓解。
苯甲酸福格列汀片(商品名:信立汀)是信立泰药业研发的一款二肽基肽酶-4(DPP-4)抑制剂,每天服用一次。DPP-4抑制剂不仅能够抑制胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素分泌多肽(GIP)的灭活,提高内源性GLP-1和GIP的水平,促进胰岛β细胞释放胰岛素,而且还能抑制胰岛α细胞分泌胰高血糖素,提高胰岛素水平,降低血糖,且不易诱发低血糖和增加体重。在两项随机、双盲的Ⅲ期临床研究中,苯甲酸复格列汀片单药或联合二甲双胍治疗2型糖尿病患者,均能显著降低血糖。
考格列汀(商品名:倍长平)是海思科医药研发的首个双周口服超长效DPP-4抑制剂。考格列汀在非常规化学位点上引入三氟甲基(CF3),实现了半衰期长达131.5小时、可持续对DPP-4酶活性产生抑制、确保14天的持续降糖效果。该药获批基于两项随机、双盲Ⅲ期临床研究,结果显示,考格列汀单药或联合二甲双胍用于治疗2型糖尿病患者,均能显著降低血糖。
卡马替尼(商品名:妥瑞达)是诺华开发的一种口服生物利用度高、高选择性的特异性MET受体酪氨酸激酶(c-Met)抑制剂。该药本次在中国获批上市基于名为GeoMETry mono-1的全球多中心临床试验,以及针对中国人群的临床研究GeoMETry-C。研究结果显示,卡马替尼在治疗METex14跳跃突变的NSCLC初治患者中的客观缓解率(ORR)和疾病控制率(DCR)分别约为70%和98%,中位总生存时间(OS)约为2年。卡马替尼此前已于2020年5月获美国食品药品管理局(FDA)批准上市。
依伏卡塞 (商品名:盖优平) 是日本药企协和麒麟开发的新一代口服钙敏感受体激动剂(拟钙剂),是一种作用于钙敏感受体(CaSR)的变构激动剂,可提高CaSR对钙离子的敏感性,直接抑制PTH的分泌和甲状旁腺细胞的增殖。此前在日本进行的依伏卡塞对比西那卡塞(一种已获批上市的拟钙剂)治疗血液透析患者SHPT研究结果显示,依伏卡塞组和西那卡塞组达到目标血清甲状旁腺激素浓度患者比例相似,达到非劣效性终点。依伏卡塞已于2018年在日本获批上市。
苯磺酸美洛加巴林(商品名:德力静)是日本药企第一三共研发的一种新一代钙离子通道调节剂,DPNP往往被称为“糖痛”,是指由糖尿病或糖尿病前期导致的周围神经病理性疼痛。DPNP会引起脊髓后角(主要是突触前膜)钙离子通道上的α2δ亚基高表达,钙离子通道异常开放,从而产生痛觉过敏和痛觉超敏。因此,阻断钙离子通道的α2δ靶点可以抑制DPNP。在此前一项美洛加巴林或安慰剂治疗DPNP患者的临床试验中,美洛加巴林组每周平均每日疼痛评分显著优于安慰剂组。美洛加巴林此前于2019年1月在日本获批上市。
罗培干扰素α-2b(商品名:百斯瑞明)是药华医药研发的新型超长效单聚乙二醇脯氨酸干扰素,2~4周注射1次,大大提高了真性红细胞增多症(PV)患者便捷性。PV是一种罕见的、慢性的致命血液癌症,为骨髓增殖性肿瘤的一种。该药本次获批是基于针对中国PV患者的Ⅱ期临床研究,结果显示,有60%的羟基脲耐药或不耐受的PV患者在使用罗培干扰素α-2b后,达到24周不进行静脉放血或红细胞单采术情况下的完全血液学缓解。罗培干扰素α-2b此前于2021年在美国获批上市。
依柯胰岛素注射液(商品名:诺和期)是诺和诺德公司研发的一种新型长效胰岛素类似物,可与白蛋白可逆性结合,在循环系统形成储库并缓慢持续释放。在一周给药间隔期内,依柯胰岛素降糖作用分布均匀,并且在临床相关剂量下降糖作用时间可覆盖一周。在2型糖尿病患者中进行的五项Ⅲ期临床研究ONWARDS 1~5结果均显示,依柯胰岛素相较于胰岛素日制剂可使更多2型糖尿病患者实现糖化血红蛋白< 7%,且治疗目标不增加低血糖风险。依柯胰岛素注射液此前已于今年5月在欧盟获批上市。
美国批准四款新药上市
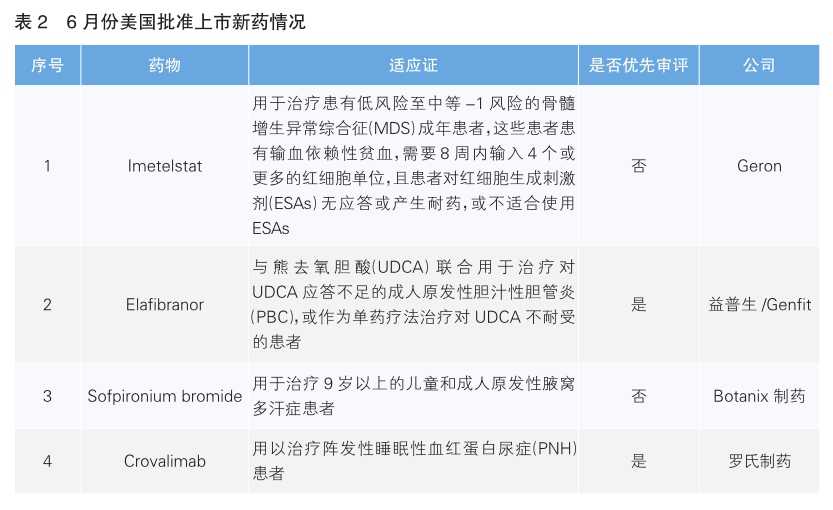
2024年6月,美国批准上市4款新药。根据Pharmadigger数据库,Imetelstat和Elafibranor是全球范围内首次获批的新药。
Imetelstat(商品名:Rytelo)是Geron公司研发的美国FDA批准的首款端粒酶抑制剂,通过靶向抑制端粒酶活性,可以抑制癌变干细胞和祖细胞不可控制的增殖,导致癌变细胞的凋亡,具有改变疾病进程的活性。低风险骨髓增生异常综合征(LR-MDS)是一种血癌,随着疾病发展,患者需要在贫血、疲劳等关键症状上逐渐强化控制,这使得LR-MDS患者经常变得依赖红细胞输血,进而导致生活质量降低与生存期的缩短。该药获批基于名为IMerge的Ⅲ期临床试验结果,与安慰剂组相比,Imetelstat治疗组患者显示出明显更高的红细胞输血独立性。
Elafibranor(商品名:Iqirvo)是Ipsen和Genefit研发的每日一次、口服、首款双重过氧化物酶体激活受体(PPAR)α/δ激动剂,是近十年来首个获批用于治疗罕见肝病原发性胆汁性胆管炎(PBC)的新药。PBC是一种严重的慢性肝病,患者由于胆管的慢性损伤,导致肝脏清除体内毒素的能力下降,引发肝硬化和肝功能衰竭。目前大约有50%的PBC患者对已有疗法应答不良或者无法耐受疗法的毒副作用。该药获批基于名为ELATIVE的Ⅲ期临床试验。结果显示,Elafibranor治疗组与安慰剂组相比,PBC疾病进展的重要预测因素碱性磷酸酶和胆红素指标均达到显著治疗获益。
Sofpironium bromide(商品名:Sofdra)是Botanix制药研发的一种抗胆碱能/抗毒蕈碱药物,通过与受体结合阻断出汗信号,从而抑制腺体出汗。这是FDA批准治疗这一症状的首款新分子实体。该疗法设计为使用专有涂抹器将Sofpironium以凝胶制剂的形式递送至腋下,使患者避免直接接触手上的药物。本次获批主要基于两项Ⅲ期临床试验,结果显示,约85%原发性腋窝多汗症患者在使用Sofpironium凝胶后病情出现具有临床意义的改善。Sofpironium bromide此前于2020年9月在日本获批上市。
Crovalimab(可伐利单抗,商品名:Piasky)是罗氏开发的一款靶向补体蛋白C5的可循环使用人源化单克隆抗体,旨在阻断人体免疫系统中的补体系统。Crovalimab是阵发性睡眠性血红蛋白尿症(PNH)的首个每月皮下注射治疗药物,且患者可以选择在受监督的医疗机构之外进行自我给药。PNH是一种罕见且危及生命的综合征,患者会突然出现血尿、贫血和血栓形成等症状。该药本次获批是基于名为COMMODORE 3的Ⅲ期临床试验,Crovalimab在研究中达到了共同主要疗效终点。Crovalimab已于今年2月在中国获批上市。
欧盟批准五款新药上市
6月份,欧盟批准了5款新药上市,根据Pharmadigger数据库,均非全球首次获批新药。
Aprocitentan(商品名:Jeraygo)是Idorsia研发的首个用于治疗难治性高血压的内皮素受体拮抗剂。该药已于今年3月在美国获批上市。
Vibegron(商品名: Obgemsa)是由Urovant Sciences开发的β3受体激动剂,2022年皮尔法伯与Urovant Sciences签订协议获得欧洲市场的开发权利。该药本次获批基于两项临床试验EMPOWUR、EMPOWUR Extension,结果显示,Vibegron在改善膀胱过度活动症尿急、尿频和急迫性尿失禁方面表现出良好获益。该药此前于2020年12月在美国获批上市。
呋喹替尼(商品名:Fruzaqla)由和黄医药研发,2023年3月,武田与和黄医药达成协议,共同在中国以外推广该药物。该药本次获批主要基于名为FRESCO-2的Ⅲ期临床研究,结果显示,接受呋喹替尼治疗患者在总生存期和无进展生存期方面均达到具有统计学和临床意义的显著改善。呋喹替尼此前于2018年9月在中国获批上市,2023年11月在美国获批。
Efanesoctocog alfa(商品名:Altuviiio)是Sobi/赛诺菲开发的首款高持续性的凝血因子Ⅷ替代疗法。该药本次获批主要基于两项关键Ⅲ期临床研究XTEND-1、XTEND-Kids,研究分别评估了Altuvoct用于成人和青年、儿童重度血友病A患者的疗效和安全性。该药此前于2023年2月在美国获批上市。
Capivasertib (商品名:Truqap) 是阿斯利康开发的AKT抑制剂。该药本次获批是基于Ⅲ期临床试验CAPItello-291,结果显示,Capivasertib联合氟维司群与氟维司群联合安慰剂相比,可将携带PI3K、AKT或PTEN突变的肿瘤患者的疾病进展或死亡风险降低一半。Capivasertib此前已于2023年11月获美国FDA批准上市。(陈倩)
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐