无菌药品附录征求意见稿发布,企业应作何关注?
- 2025-03-19 14:54
- 作者:张瑜华
- 来源:
3月17日,国家药监局发布《药品生产质量管理规范(2010年修订)》无菌药品附录(征求意见稿)(以下简称征求意见稿),向社会公开征求意见。笔者在学习征求意见稿的基础上,结合欧盟GMP附录1《无菌药品生产》(以下简称欧盟GMP附录)谈谈企业在无菌药品生产过程中应关注哪些事项。
征求意见稿的变化
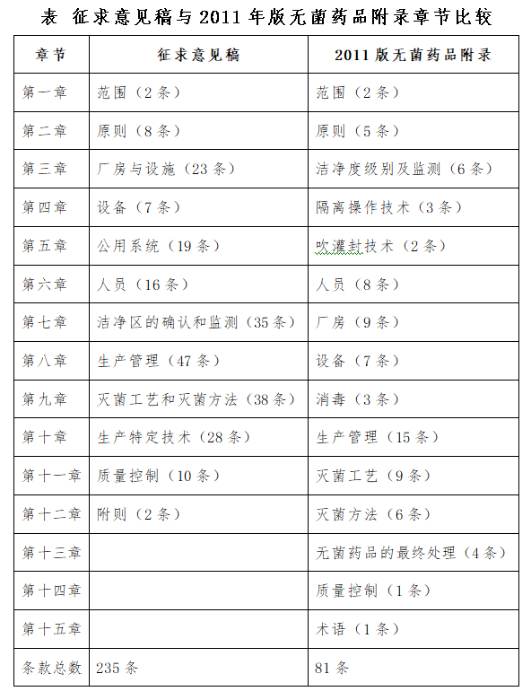
我国现行无菌药品附录于2011年颁布,征求意见稿与2011年版无菌药品附录相比,作了较大修改和提升,条款数量是2011年版无菌药品附录的3倍,字数是2011年版无菌药品附录的近4倍,细化了一些原则性要求,公用系统单列一章,增加了生产特定技术(如成型—灌装—密封技术、密闭系统、一次性使用系统等),更是与欧盟GMP附录接轨。全文以药品质量体系(PQS)为基础,有助于将有效的质量风险管理整合到无菌药品全生命周期的所有领域,最大限度地减少微生物污染并保障无菌药品的质量。
PQS涵盖无菌药品生产全过程
无菌药品的生产是一项复杂的活动,需要采取特定的控制和措施以确保产品的质量。企业的PQS应当涵盖并满足无菌药品生产的特定要求,并确保所有活动得到有效控制,以尽可能降低无菌药品中的微生物、微粒和细菌内毒素/热原污染风险。无菌药品的PQS应当确保以下事项。
1.应有一个有效的与产品生命周期相结合的风险管理系统,以降低微生物污染,确保无菌生产的药品质量。
2.必须严格按照经验证的方法及规程进行,以保障产品的无菌性。无菌药品生产用厂房、设施、设备应当经过确认或验证,并保持持续的验证状态。
3.应当建立污染控制策略(CCS),确定所有关键控制点,并评估药品质量管理、风险控制以及监测措施的有效性。
4.生产者应具有足够的与产品生产有关的设备、生产相关的知识和经验,并对程序上的、工艺或设备偏差的根本原因进行分析并实施恰当的纠正措施和预防措施(CAPA)。
5.高层管理人员应当有效监督企业总体情况以及药品全生命周期中的受控状态,持续改进质量管理。
6.负责无菌产品质量放行人员应能获得足够的生产及质量信息,并具备足够的无菌剂型生产和关键质量属性的知识和经验。
人员培训及行为确保符合无菌生产要求
所有人员都应当接受无菌生产相关培训,需经培训上岗。养成个人卫生习惯,洁净服与生产操作的要求及操作区的洁净度级别相适应,更换及确认符合无菌更衣规程。洗涤、灭菌时无附加的颗粒物质,制定工作服清洗周期。
1.所有人员,包括执行清洁、维护、监控以及进入洁净区的人员,均应定期接受无菌药品生产相关培训、更衣确认和生产行为规范性评估。培训内容包括卫生和微生物方面的基础知识,特别关注洁净区操作、污染控制、无菌技术和无菌药品保护。
2.在A级区和B级区工作的人员应接受无菌更衣、无菌规范及气流可视化的培训。应评估和确认符合无菌更衣规程,至少每年定期再评估,并应包括目检和微生物评估(使用手、胳膊、胸部和额头等监测位置)。
3.尽量减少进入无菌生产洁净区的人数和次数,进入洁净区的人数应通过验证来确定。
4.洁净区更衣和洗手应遵循相应书面规程,以最大限度减少洁净服污染或减少污染物转移至洁净区。
5.洁净区内人员移动应缓慢、受控,以避免由于过度活动导致的微粒和微生物的过量散发。执行无菌操作的操作人员应始终遵循无菌操作技术,以防洁净度较低的空气进入关键区域。限制关键区域附近的移动,避免阻碍首过空气的路径。
厂房及设备突出屏障技术
无菌产品的生产应在洁净区内进行,应通过更衣室进入洁净区。洁净区和更衣室应保持适当的洁净度标准,并向洁净区提供过滤的空气。征求意见稿增添了防止污染的屏障技术新内容,如限制进入屏障系统(RABS)和隔离器,各种操作应在具备适当的技术性和操作性隔离措施的洁净区或设施中进行,以防止混淆和污染。
1.更衣室和物流通道应当按照气锁方式设计,尽可能避免不同区域间的交叉污染。
2.传递窗和气锁间两侧的门不得同时打开。通向A/B级区的气锁间应当采用互锁系统,通向C级或D级区的气锁间至少应当采用声光报警系统,避免两侧的门同时打开。
3.CCS应考虑使用限制性进入屏障系统和隔离器有利于确保所需的条件,并最大限度减少与关键区直接人为干预措施相关的微生物污染。
4.隔离器的设计应当确保工作区域达到A级要求。开放式隔离器以及内部包含生产线的密闭式隔离器,应当在关键区域提供首过空气保护,同时在整个生产过程中保持对暴露产品的单向流吹扫。开放式隔离器的背景环境通常至少为C级,密闭式隔离器的背景应当至少为D级。
5.RABS应当通过单向流和首过空气等设计确保关键区域达到A级要求。用于无菌生产工艺的RABS的背景环境应当至少为B级,应当进行气流流型研究,证明干预过程中没有空气进入。
6.洁净区气流流型研究应可视化,静态和动态(如模拟操作员的干预)都应进行气流流型研究,并保留录像。
公共系统控制与风险相适应
公共系统的设计、安装、操作、维护和监测应确保公共系统按预期运行。高风险公共系统的关键参数和关键质量属性应定期进行趋势分析,以确保系统保持适当性能。
1.应保存公共系统的安装记录,包括管道流向、坡度、管径和长度;储罐和容器的信息;阀门、过滤器、排水设施、取样点和使用点等。
2.纯化水、注射用水在分配系统管路中应当保持湍流状态,最大程度降低微生物黏附、形成生物膜等风险。应当在确认时确定流速,并进行日常监测。
3.应当按照确认的周期对水系统进行灭菌或消毒;当水系统监测结果达到纠偏限度或超标时,也应当采取灭菌或消毒的措施。
4.纯蒸汽(洁净蒸汽)发生器的进水应当适当纯化。纯蒸汽发生器及其分配系统的设计、安装、运行应当确保纯蒸汽质量达到设定的标准。灭菌用蒸汽应当符合设定的质量要求,且含添加剂的量不应当给产品或设备造成污染。
5.纯蒸汽发生器的原水应适当净化。纯蒸汽发生器的设计、确认和操作方式应确保产生的蒸汽的质量符合规定的化学和内毒素水平。
生产和特定技术基于CCS
无菌药品生产的每个阶段(包括灭菌前的各阶段),应当依据CCS采取措施降低微生物、微粒和细菌内毒素/热原的污染。
1.应当尽可能减少无菌生产每个阶段的时间,规定相应间隔时间的控制标准并经过验证。
2.无菌工艺模拟应当尽可能模拟常规的无菌生产工艺,包括所有对无菌结果有影响的关键操作,以及生产中可能出现的各种干预和最差条件。
3.灭菌工艺验证应当考虑产品成分、储存条件以及从待灭菌产品配制或物料准备开始至其灭菌之间的最长时限。
4.可最终灭菌的产品不得以过滤除菌工艺替代最终灭菌工艺。如需除菌过滤,应当采取措施降低过滤除菌的风险,可在最终除菌过滤器前安装多个已灭菌的除菌或减菌级过滤器,以降低最终除菌过滤前药液的微生物负荷,最终的除菌过滤滤器应当尽可能接近灌装点。
5.成型—灌装—密封技术(FFS)工艺中包装组件的装配、包装膜或成型容器的使用和处理过程应当有效控制,以尽可能降低污染的风险。应当对FFS设备的运行情况进行评估,包括组装/成型、灌装、密封以及切割过程,以充分理解、验证、控制和监控关键工艺参数。
6.用于生产最终灭菌产品的吹—灌—封(BFS)设备至少应当安装在D级洁净区环境中。BFS环境控制和监测应当考虑工艺中的部件移动、复杂的气流路径以及持续输出高热的影响。
7.密闭系统的设计和选择应当确保维持无菌性。最终除菌过滤器之后的管路应当采用无菌连接。应当采取适当的措施确保无菌连接所用组件的完整性。
8.一次性使用系统(SUS)的设计应当减少操作需求,降低人工干预的复杂性。SUS的灭菌工艺应当经过验证,证明对系统性能无不良影响。
(作者:江西省、吉林省药监局药品检查员,副主任药师、执业药师 张瑜华)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘鹤)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-

-

执法实务|关于无证医疗器械认定的探讨
准确认定无证医疗器械,是有效打击相关违法行为、净化市场环境、保障公众用械安全的关键环节。但由于市场上产品形态多样、违法行为隐蔽等因素,使无证医疗器械的认定工作日趋复杂。本文对无证医... 2025-10-21 16:37
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有