1月份中美欧批准上市新药盘点 六款我国自主研发的新药在全球范围内首次获批上市
- 2025-02-27 15:40
- 作者:陈倩
- 来源:
今年1月份中美欧批准上市的新药中,中国批准上市的新药数量最多,为8款,其中有6款是我国自主研发的新药;美国批准3款新药上市;欧盟批准4款新药上市。
中国批准八款新药上市
1月份,我国批准了8款新药上市,根据Pharmadigger数据库,除了艾沙妥昔单抗和厄达替尼外,其余均为全球范围内首次批准上市新药,且均为我国企业自主研发的新药。
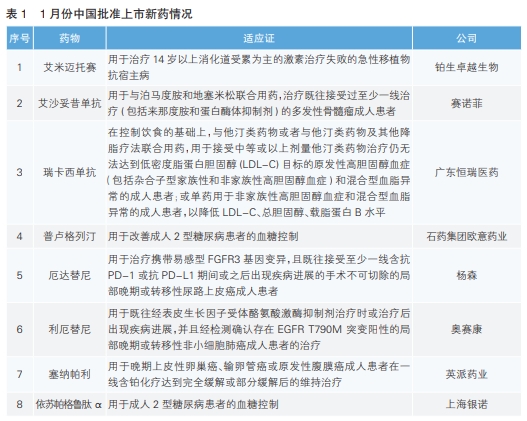
艾米迈托赛(商品名:睿铂生)是铂生卓越生物科技(北京)有限公司自主研发的脐带间充质干细胞治疗产品,用于治疗14岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病。该产品是国内首款获批上市的干细胞治疗产品。间充质干细胞是一种具有自我更新和多系分化能力的细胞,广泛分布于人体各组织器官,可以为周围的器官特异性细胞提供结构和营养支持,还具有独特的免疫调节作用,能够通过多种机制影响先天免疫和适应性免疫功能。该药本次附条件获批是基于一项Ⅱ期临床试验,结果显示,艾米迈托赛组患者相较于安慰剂组客观缓解率显著提高。
艾沙妥昔单抗(商品名:赛可益)是赛诺菲研发的靶向CD38的IgG1κ型单克隆抗体,可直接诱导骨髓瘤细胞凋亡,其特殊的结构和结合表位带来了更强的抗肿瘤活性。该药本次获批是基于全球Ⅲ期临床试验ICARIA-MM以及中国的真实世界研究lsaFiRsT结果。ICARIAMM研究结果显示,艾沙妥昔单抗注射液联合泊马度胺和小剂量地塞米松可显著降低40%疾病进展或死亡风险;IsaFiRsT研究结果显示,该药对复发或难治性多发性骨髓瘤患者的总体缓解率达到82.6%。艾沙妥昔单抗是我国首个利用真实世界数据获批上市的血液肿瘤治疗药物,该药此前已于2020年3月在美国获批上市。
瑞卡西单抗(商品名:艾心安)是广东恒瑞医药有限公司自主研发的抗PCSK9的单克隆抗体,通过优选lgG1蛋白亚型,提升与抗原结合的特异性和亲和力,并引入“YTE”氨基酸突变技术延长其在体内的半衰期,使得患者用药频率可变为4周或8周一次。该药本次获批是基于3项Ⅲ期临床研究(SHR-1209-301、SHR-1209-302、SHR-1209-303)。这些试验评估了瑞卡西单抗在治疗高胆固醇血症和混合型血脂异常中的疗效与安全性。研究显示,瑞卡西单抗在降低低密度脂蛋白胆固醇、总胆固醇、非高密度脂蛋白胆固醇等血脂指标方面表现优异。
普卢格列汀(商品名:善泽平)是石药集团欧意药业有限公司自主研发的新型口服二肽基肽酶-IV(DPP-4)抑制剂,对DPP-4具有高选择性和强抑制性。该产品通过抑制DPP-4,使内源性活性胰高血糖素样肽-1(GLP-1)水平升高,从而增强β细胞和α细胞对葡萄糖的敏感性,增加葡萄糖刺激的胰岛素分泌,并增强葡萄糖对胰高血糖素分泌的抑制作用,进而降低血糖水平。该药本次获批是基于两项关键Ⅲ期临床试验(普卢格列汀片单药Ⅲ期临床试验和普卢格列汀片联合盐酸二甲双胍Ⅲ期临床试验),结果均显示该产品具有持久的降糖作用且不易诱发低血糖和增加体重。
厄达替尼(商品名:博珂)是杨森研发的一种全成纤维细胞生长因子受体(FGFR)抑制剂,有显著的抗肿瘤活性。膀胱癌是中国男性常见的肿瘤之一,其中最常见的类型是尿路上皮癌,约占所有病例的90%。该药本次获批是基于一项名为THOR的Ⅲ期临床研究。结果显示,与化疗相比,使用厄达替尼治疗的携带FGFR3基因变异患者死亡风险降低了36%。厄达替尼此前已于2019年4月在美国获批上市。
利厄替尼(商品名:奥壹新)是奥赛康自主研发的一种第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。一项Ⅱb期临床研究结果显示,利厄替尼用于既往经EGFRTKI治疗后进展的EGFR T790M+局部晚期或转移性非小细胞肺癌的患者,客观缓解率和疾病控制率分别约为70%和93%。
塞纳帕利(商品名:派舒宁)是英派药业自主研发的新型、高效的PARP1/2抑制剂。该药本次获批是基于一项名为FLAMES的研究,结果显示,塞纳帕利维持治疗能够显著延长晚期卵巢癌患者的中位无进展生存期,且不论患者的BRCA基因表达如何,均能从塞纳帕利治疗中获益。卵巢癌是最常见的致死性女性生殖道恶性肿瘤之一。
依苏帕格鲁肽α(商品名:怡诺轻)是上海银诺医药技术有限公司自主研发的一种长效GLP-1受体激动剂,是GLP-1与人免疫球蛋白G2的Fc片段融合形成的重组蛋白,可以血糖依赖性地增加胰岛素分泌,抑制胰高血糖素释放。该药是我国首个拥有自主知识产权的人源、超长效GLP-1药物。该药本次获批是基于名为YN011-301和YN011-302的两项研究,结果显示依苏帕格鲁肽α单药或与二甲双胍联用均能显著改善糖化血红蛋白水平。
美国批准三款新药上市
1月份,美国批准上市3款新药。根据Pharmadigger数据库,Treosulfan和Suzetrigine为全球范围内首次获批的新药。

Datopotamab deruxtecan(商品名:Datroway)由第一三共与阿斯利康共同研发。该药是一款靶向TROP2的DXd抗体偶联药物,由人源化抗TROP2 IgG1单克隆抗体,通过可裂解四肽连接子与多个拓扑异构酶Ⅰ抑制剂有效载荷(一种依喜替康衍生物)连接组成。该药本次获批是基于Ⅲ期临床研究TROPION-Breast01的结果。研究结果显示,在HR阳性、HER2阴性转移性乳腺癌患者中,与化疗相比,该药可显著降低疾病进展或死亡风险。Datopotamab deruxtecan此前已于2024年12月在日本获批上市。
Treosulfan(商品名:Grafapex)是Medexus制药研发的一种双功能烷基化剂前药,对造血干细胞具有细胞毒性。Treosulfan可以自发地在特定pH条件下转化为单环氧化物中间体和二环氧丁烷。该药本次获批是基于一项Ⅲ期临床试验,结果显示,与白消安组相比,Treosulfan组能改善患者总生存期约33%。
Suzetrigine(商品名:Journavx)是Vertex制药研发的一款口服选择性NaV1.8(一种电压门控钠通道,选择性地表达于外周痛觉神经元)抑制剂。该药对NaV1.8具有高度选择性,是近20多年来获批的首款非阿片类镇痛药。与阿片类药物相比,该药可在提供更好镇痛效果的同时,避免成瘾等副作用。该药本次获批是基于两项针对急性手术疼痛的试验,其中一项试验是在腹部整形术后进行的,另一项则是在拇囊切除术后进行的。
欧盟批准四款新药上市
1月份,欧盟批准了4款新药上市,根据Pharmadigger数据库,均非全球首次批准上市新药。

Sipavibart(商品名:Kavigale)是阿斯利康研发的一种针对SARS-CoV-2刺突蛋白的人源IgG1λ单抗药物。一项名为SUPERNOVA的试验结果显示,与对照组(Tixagevimab/ Cilgavimab或安慰剂)相比,Sipavibart在免疫功能低下的患者群体中显著降低了有症状COVID-19的发生率。Sipavibart此前已于2024年12月在日本获批上市。
Lazertinib(商品名:Lazcluze)是强生研发的一款人源化EGFR/MET靶向双特异性抗体。该药本次获批是基于一项名为MARIPOSA的Ⅲ期临床试验。结果显示,Amivantamab与Lazertinib联用,与对照组Osimertinib相比,可将疾病进展或死亡风险降低30%。Lazertinib此前已于2024年8月在美国获批上市。
Repotrectinib(商品名:Augtyro)是百时美施贵宝研发的一种原肌球蛋白受体激酶抑制剂。该药靶向的是由基因融合和原癌基因酪氨酸蛋白激酶ROS引起的TRK蛋白持续活化的细胞。Repotrectinib已于2023年11月在美国获批上市。
Vilobelimab(商品名:Gohibic)是InflaRx研发的抗人补体因子C5a单克隆抗体,可高效阻断C5a的生物活性,并对人体血液中的靶标具有高选择性,是欧盟批准的首个也是唯一一个用于治疗SARS-CoV-2诱发的急性呼吸窘迫综合征的药物。Vilobelimab已于2023年4月在美国获得紧急授权使用。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐