国家药监局器械长三角分中心真抓实干探索区域监管新路径
- 2024-06-13 09:23
- 作者:郭婷
- 来源:中国医药报
“分中心就在‘家门口’,我们遇到问题可以及时与审评员面对面沟通交流。尤其对于创新医疗器械,审评员帮助解答产品注册技术性问题,可以让我们少走弯路,这是对企业实实在在的帮助。”日前,上海联影医疗科技股份有限公司(以下简称联影医疗)法规注册总监刘建霞在接受记者采访时,对国家药监局医疗器械技术审评检查长三角分中心(以下简称分中心)的工作给予高度评价。
2020年12月22日,分中心在上海市浦东新区张江科学城挂牌成立。三年多来,分中心纵深推进监管能力建设,持续完善咨询辅导工作机制,不断优化服务创新举措,为长三角区域医疗器械产业高质量发展蓄力赋能。
截至2023年底,分中心签收长三角区域医疗器械注册申请人各类申请事项11000余件,均严格按时限完成;共参与完成国家药监局食品药品审核查验中心(以下简称核查中心)组织的医疗器械临床试验等相关核查任务17人次;累计答复长三角区域医疗器械申请人注册受理前技术咨询近6500件……
夯实人才基础
提升队伍专业素养
“分中心的设立是贯彻落实党中央、国务院战略部署,加快推进长三角区域医疗器械产业创新与高质量发展的一项重要举措。”分中心主任李耀华表示,在国家药监局党组的坚强领导下,在上海市委、市政府和相关单位的大力支持下,分中心围绕区域产业发展需求,扎实推进各项工作,在完善制度机制、加强能力建设和开展业务工作等方面均取得明显成效。
自成立以来,分中心始终把党的政治建设摆在首位。2021年4月,经国家药监局机关党委批复同意,分中心党支部正式成立;2023年1月,组织召开党员大会选举产生党支部委员会,党组织进一步完善,党的领导进一步加强;2023年上半年,分别成立工会和团支部,进一步发挥基层群团工作强大合力,提升组织凝聚力、战斗力和向心力。目前,分中心党支部共有党员44名,占职工总数的53%。

2022年10月25日,分中心党支部组织党员干部参观中共一大会址。
分中心的主要职责包括:协助国家药监局医疗器械技术审评中心(以下简称器审中心)开展长三角区域内医疗器械审评事前事中沟通指导工作及国产第三类医疗器械产品和进口医疗器械产品的技术审评工作;协助核查中心开展长三角区域内医疗器械临床试验监督抽查工作等。
三年多来,分中心立足自身职能定位,注重加强人才队伍能力建设,加快推进人员招聘与培训工作,现有职工83人,其中专业技术人员占比87%。针对年轻同志多、新入职人员多等特点,分中心积极组织开展岗前培训、综合能力培训、能力建设竞赛等多样化内部培训;组织人员到相关重点实验室、临床机构、生产企业及相关单位开展实训20余次;同时,先后选派61名新入职人员分批赴器审中心、核查中心轮训学习。目前,分中心共有40名审评员具备不同专业方向的B级或C级审评资质,5人具备国家级GCP检查员资质,6人具备国家级GMP检查员资质。
此外,分中心高度重视制度建设,参照国家药监局、器审中心及上海市相关管理要求,制定印发内部管理及业务制度82项;严格落实“统一审评体系、统一业务流程、统一审评尺度”工作要求,完全执行器审中心审评业务制度55项;在器审中心审评质量体系覆盖的基础上,建立并有效运行完备的审评检查质量管理体系,并结合实际,制定完成质量手册、程序文件与岗位手册,形成覆盖现有工作、一人一册的岗位作业指导书。分中心的内部管理运行机制不断完善,审评检查各项工作的开展充分实现了有据可依。
能力建设永无止境。2023年,分中心在巩固前期阶段成果、认真总结经验的基础上,制定了高质量建设发展三年行动方案。方案提出了提高审评检查质量、助推产业高质量发展、提升队伍专业素养、强化智慧监管等重点任务,将服务长三角区域医疗器械产业高质量发展向纵深推进。
完善咨询机制
开展“定制化”培训
“长三角区域创新研发型企业密布,且在很多领域处于国内领先地位,对于注册审评沟通、交流、辅导的需求极其旺盛,分中心在筹建初期就启动了咨询辅导工作。”李耀华介绍,三年多来,分中心按照“有问题提前解决”的服务思路,不断完善咨询辅导工作机制,拓宽沟通交流渠道,提升咨询服务质量。
分中心积极搭建并畅通沟通交流渠道,自2021年5月13日起,开始为长三角区域内医疗器械研制机构、生产企业提供现场咨询和邮件咨询指导。自2022年11月1日起,按照器审中心咨询答疑工作总体安排,分中心在开展针对长三角区域境内第三类医疗器械研制机构、生产企业的注册受理前技术问题咨询的基础上,正式启动针对区域进口医疗器械注册代理人的咨询辅导工作。
据统计,截至2023年底,分中心已累计答复长三角区域医疗器械申请人注册受理前技术咨询近6500件,其中现场咨询近1300件、邮件咨询近5200件。

2024年4月25日,分中心审评员在接受医疗器械申请人注册受理前技术问题咨询。
“沟通渠道更多、回复速度更快、指导专业性更强。”微创投资控股有限公司注册资深总监单畅,言简意赅地总结了分中心咨询辅导工作开展三年来的变化。
之所以可以实现咨询辅导“质”“效”双提升,正是得益于分中心不断健全完善咨询服务机制,建立咨询工作质量管理规范、咨询技术委员会集体研究等制度,有效规范了咨询业务的工作流程。值得一提的是,为了提升咨询服务质量,分中心综合业务部(质量管理部)通过定期抽查邮件咨询回复质量、定期开展面向申请人的满意度调查等方式,监督、检查注册受理前技术问题咨询工作的开展情况。
2023年,分中心共召开3次咨询技术委员会会议,重点研究确定共性问题的答复意见;开展4次满意度调查,重点围绕咨询受理和回复环节的沟通交流态度、沟通时限、专业性等进行调查,调查平均得分9.65分(满分10分),总体满意度较高。
在做好咨询辅导的同时,分中心还探索开展“定制化、小班化”培训。长三角区域医疗器械注册申请人数量庞大,培训需求多样,分中心在广泛征求区域产业培训需求的基础上,制定年度系列专题培训计划,针对性设置课程,满足多样化的培训需求。
“我明显感受到,分中心组织的培训越来越多,且主题越来越细分。”上海之江生物科技股份有限公司注册部经理吴梅表示,近年来,分中心采取多种方式,广泛收集企业需求,积极听取企业建议,自己曾参加过两次面向企业征集需求的座谈会,平时还可以通过很多线上渠道反馈需求。

2023年12月8日,分中心在江苏常州组织开展医疗器械临床评价专题培训。
为提升培训工作质量,分中心还与地方药监部门联合发力,建立培训“双反馈”工作机制,即培训前联合长三角区域药品监管部门,广泛征集培训相关的各类诉求、意见建议,科学合理设置培训课程;培训后及时收集参训单位的意见反馈,了解参训单位对课程设置、培训方式等方面的意见建议,科学评估培训效果。
统计显示,自成立以来,分中心已组织开展区域有源医疗器械、无源医疗器械、体外诊断试剂等主题培训13场,累计培训区域研发注册相关企业逾3500家,培训正逐渐成为分中心的一张“特色名片”。
专人对接辅导
助力创新产品上市
2023年9月14日,上海微创医疗机器人(集团)股份有限公司(以下简称微创机器人公司)研发生产的产品“腹腔内窥镜手术系统”名称变更为“胸腹腔内窥镜手术系统”,适用范围由“泌尿外科”变更为“泌尿外科、普通外科、妇科、胸外科”。
“此次变更比较复杂,增加适用范围覆盖多个科室,在临床试验方面存在很多困难。分中心审评员为我们解读法规要求、梳理问题,并组织召开专家研讨会,切实帮助解决临床试验难点,最终顺利推动胸腹腔内窥镜手术系统实现多个适应证同步获批。”单畅对分中心的辅导工作连连称赞。
事实上,腹腔内窥镜手术系统最初获批上市也离不开分中心的辅导。该产品于2019年10月进入国家药监局创新医疗器械特别审查通道后,分中心指派“辅导员”主动对接,并多次组织召开专家研讨会,邀请临床专家对临床试验方案设计中的关键点提出建议。
在器审中心和分中心对注册申报工作的指导下,腹腔内窥镜手术系统于2022年1月获批上市。微创机器人公司特意将一面写有“创新辅导排忧解难服务产业助力发展”的锦旗送到分中心,对分中心给予的专业指导和靠前服务表示感谢。
这只是分中心服务创新医疗器械发展的一个缩影。据了解,对于长三角区域已纳入创新医疗器械特别审查通道的医疗器械,分中心建立了完善的创新产品专人辅导机制,按照“提前介入、专人负责、全程指导”的工作思路,为创新产品分配“辅导员”,主动跟进产品研发及注册进度,提供“一对一”咨询辅导。
助推国产首台质子治疗系统获批上市是分中心服务创新医疗器械发展的又一生动实例。2022年9月26日,国家药监局批准了上海艾普强粒子设备有限公司生产的质子治疗系统创新产品注册申请。据了解,该产品于2021年1月11日进入创新医疗器械特别审查通道。从2021年5月开始,分中心的审评员多次到瑞金医院肿瘤质子中心考察调研。在器审中心的指导下,组织召开专题沟通交流会,协助解决企业在产品临床试验、注册检测、研究资料准备等环节的具体问题。因前期沟通充分及时,该产品在注册申报被受理后不久即获批上市。
“联影医疗已有7款创新医疗器械产品获批上市,其中多款产品的成功获批都受益于分中心的创新产品专人辅导机制。”刘建霞表示,医疗器械临床评价通常是企业新产品设计开发过程中耗时最长、成本最高的一个环节,尤其是创新产品往往没有可参考的相关指导文件,容易走弯路,造成时间成本上的巨大浪费。分中心指派专人主动对接服务企业,更加及时精准地帮助企业开展创新医疗器械注册申报,助推创新产品加速上市。
截至2023年底,分中心主动服务的创新医疗器械累计136个,其中经辅导已获批上市的创新产品达40个。
深耕区域服务
助推产业高质量发展
在分中心的医疗器械数字化演示厅,一块巨大的电子屏幕引人瞩目,屏幕上滚动播放着长三角区域内重点医疗器械产品的相关数据。这是分中心自主设计开发的长三角区域医疗器械产业创新发展地图数字化展示系统。
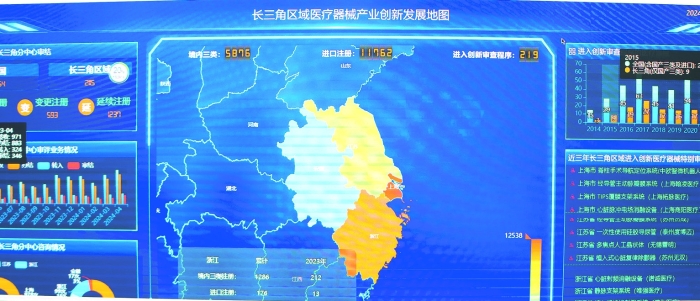
分中心设计开发的长三角区域医疗器械产业创新发展地图数字化展示系统大屏。
“分中心是国家药监局服务支持长三角区域发展战略的前哨站,应充分利用区位优势,深入调研了解区域产业创新发展现状。只有基本摸清区域产业创新发展的底数和需求,才能更加精准地服务支持区域创新型医疗器械研发,助推产业高质量发展。”在李耀华看来,创新发展地图的绘制为分中心制定更具针对性的服务举措提供了依据。
长三角区域是我国医疗器械创新高地、注册申报重要来源地和集聚地,也是我国医疗器械产业发展最活跃、开放程度最高、创新能力最强的区域之一。数据显示,长三角区域内医疗器械生产企业9000余家、医疗器械经营企业近20万家,境内第三类医疗器械产品约占全国总量的40%,进口医疗器械(代理人所在地)约占全国总量的70%,高端医疗装备、心血管植入产品等创新医疗器械加速涌现。
2023年以来,分中心成立四个区域调研小组,分别在上海市、江苏省、浙江省、安徽省调研走访,深度排摸长三角区域医疗器械产业创新发展现状。调研小组摸排了区域内近500项处于研发阶段且尚未申报注册的国产第三类医疗器械,筛选出部分可能实现关键技术、关键材料、核心零部件重大突破,拥有自主知识产权,有可能完成国产替代,解决“卡脖子”问题的创新型、急需型在研医疗器械。
分中心秉持“集中审评力量,服务真正具有创新性产品”的理念,确立了“分级服务”“扶持重点”的工作思路,先后确定三批近百个区域重点产品。同时,制定了区域重点产品沟通指导方案,推动沟通指导服务进一步向研发阶段前移,为产品加速上市提供助力。
“联影医疗的正电子发射/X射线计算机断层成像系统在2023年4月被纳入第一批区域重点产品清单。这款在研产品得到了分中心的前置沟通指导,有专人主动跟踪项目进度,解答企业的注册技术问题。”刘建霞说。
分中心以前期调研数据为基础,开发建设了长三角区域医疗器械产业创新发展地图,并打造数字化展示系统。据介绍,目前数字化展示系统主要作为分中心审评业务信息汇总平台、重点产品动态跟踪平台。接下来,分中心计划进一步提升创新发展地图的系统性、功能性,增加业务数据的实时反馈功能,探索将审评系统与创新发展地图数字化展示系统实现联动。
“我们将继续扩大区域重点产品服务范围,着力解决区域医疗器械企业在注册申报工作中的堵点、淤点和难点,以真干实干服务区域产业发展。”李耀华说,分中心将锚定促进产业创新发展、增强企业获得感这一目标,立足长远、久久为功。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:申杨)
分享至
右键点击另存二维码!
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有