基于NGS技术的非小细胞肺癌基因变异检测试剂审评现状及审评关注点
- 2022-05-27 17:21
- 作者:方丽
- 来源:中国食品药品网
高通量测序技术(high-throughput sequencing)即下一代测序(next generation sequencing,NGS)技术,正在广泛用于肿瘤诊疗相关领域,用于检测肿瘤组织中的基因变异。肿瘤基因变异类型包括点突变、插入、缺失、基因重排/融合、拷贝数异常等。伴随着精准医疗的蓬勃发展,NGS技术在抗肿瘤药物的伴随诊断领域也起到了至关重要的作用。
肺癌是我国发病率和死亡率最高的恶性肿瘤。按照病理学分类,其可分为非小细胞肺癌(non-small cell lung cancer, NSCLL)和小细胞肺癌(small cell lung cancer, SCLL)两种类型,其中NSCLL是最为常见的组织学类型。随着分子生物学技术的发展,人们对于NSCLL的认识已经从组织水平发展到分子水平,越来越多的肿瘤相关基因变异被发现,基于基因变异的靶向治疗在NSCLL的抗肿瘤治疗中起到了显著的临床效果。
近年来,基于NGS技术的肿瘤基因变异检测试剂的申报逐渐增多,尤其以针对NSCLL居多。与常规的基于PCR技术的产品不同,此类产品相对比较复杂,所涵盖的基因及变异类型较多;同时,此类产品的技术原理、产品设计也与PCR试剂不同。因此,有必要针对基于NGS技术的肿瘤基因变异检测试剂的产品设计、临床试验方法、临床证据的提交等进行研究。
国内相关产品注册情况
2018年,广州燃石医学检验所有限公司的人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)、天津诺禾致源生物信息科技有限公司的人EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因突变检测试剂盒(半导体测序法)、厦门艾德生物医药科技股份有限公司的人类10基因突变联合检测试剂盒(可逆末端终止测序法)、南京世和医疗器械有限公司的EGFR/ALK/ROS1/BRAF/KRAS/HER2基因突变检测试剂盒(可逆末端终止测序法)作为第一批基于NGS技术的用于NSCLL的基因变异检测试剂进入创新通道而获批上市。截至目前,已有十余个产品获批,且还有较多产品正在申报过程中。
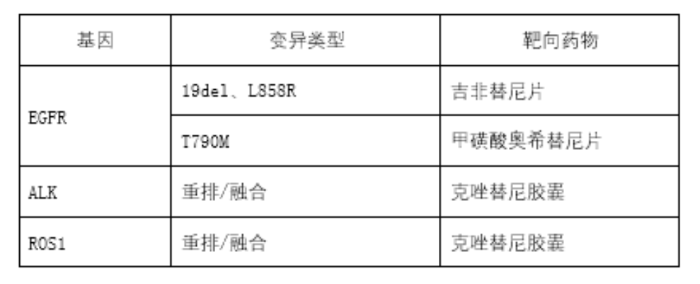
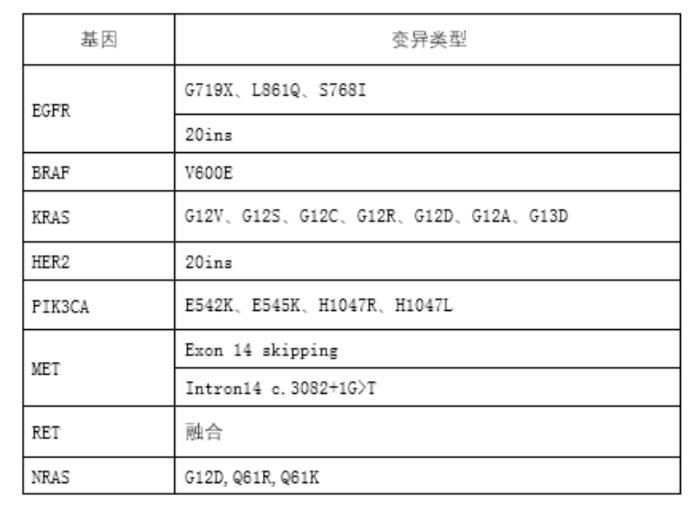
从已获批产品以及尚在申报过程中的产品来看,其所采用的NGS技术主要基于三大技术平台:可逆末端终止测序法、半导体测序法、联合探针锚定聚合测序法。上述产品的说明书中均明确了伴随诊断用途的基因变异类型及相应的靶向药物(详见表1),以及仅进行了检测性能评价的基因变异类型(详见表2)。
表1 伴随诊断用途的基因变异类型及相应的靶向药物
表2 仅进行了检测性能评价的基因变异类型
产品审评关注点
在产品审评方面,重点关注产品设计和临床证据。
产品设计
随着NGS技术逐渐应用于临床,越来越多的基因及变异类型被发现。然而,个体的基因变异其相应的临床意义并未被充分证实。尽管NGS技术可以实现对几十个甚至几百个基因的变异进行检测,但作为IVD产品并不是所包含的基因及变异类型越多越好,申请人应综合考虑产品的风险受益以及患者的经济负担等多方面因素,产品所涵盖的基因及变异类型均应为已经过充分的临床验证的。申请人在进行产品设计时应以NSCLL相关的临床诊疗指南等行业公认的指导性文件作为参考,将用于指导抗肿瘤药物的伴随诊断基因位点作为一级位点,其他已明确写入诊疗指南但并不具有明确的伴随诊断临床意义的基因及位点,则可作为二级位点。
根据美国国家综合癌症网络(NCCN)更新发布的《NCCN 非小细胞肺癌临床诊治指南》,对NSCLL进行分子标志物的检测是非常重要的,不仅能够识别出可能有效的靶向治疗,并且可以避免可能不会带来受益的治疗。该指南建议,对NSCLC患者进行至少8种与NSCLC个性化治疗方案高度相关的驱动基因检测,以确定最佳的治疗方案。8种基因包括:EGFR(19外显子缺失、21号外显子L858R点突变、19外显子插入及L861Q、G719X、S768I点突变、20外显子T790M突变、20外显子插入) 、ALK(重排/融合)、ROS1(重排/融合)、BRAF点突变(V600E)、KRAS点突变(12密码子点突变)、MET(第14号外显子跳跃突变)、RET(重排)、NTRK(融合)。
我国《非小细胞肺癌分子病理检测临床实践指南(2021版)》指出,作为必检基因推荐的包括:EGFR(第18-21号外显子点突变、缺失、插入)、ALK(重排/融合)、ROS1(重排/融合)、MET(第14号外显子跳跃突变);扩展基因包括:MET(扩增)、HER2(第20号外显子插入突变)、BRAF(V600)、RET(重排/融合)、KRAS(第2,3外显子点突变)、NTRK(重排/融合)、肿瘤突变负荷(突变、缺失、插入等)。
考虑到我国NSCLC患者特有的基因变异频率、药物在我国的获批适应证及药物可及性,中国临床肿瘤学会(CSCO)非小细胞肺癌(NSCLC)专家委员会发布的《2020 CSCO非小细胞肺癌诊疗指南》明确指出,对于不可手术的晚期NSCLC患者,推荐的首次分子标志物检测内容必须包含EGFR、ALK、ROS1三个基因。此外,《二代测序技术在NSCLC中的临床应用中国专家共识(2020版)》中明确推荐使用国家药监局批准的检测产品,无论使用PCR、FISH或NGS方法,建议同时检测EGFR突变、ALK融合和ROS1融合三种形式的基因变异。
需要提醒申请人的是,产品如作为非原研伴随诊断试剂,在基因位点的覆盖上应尽量与原研伴随诊断试剂一致。
临床证据
临床性能评价
通过与已上市的同类产品或核酸测序等参考方法进行比较研究,评估申报产品的临床检测性能。在此部分临床试验中,应对申报产品所能检测的基因及变异类型进行充分评价。对于临床上发生频率较低的变异,临床试验中无法入组足够的阳性病例,审评中应综合考虑该变异的类型、所在的位置、与该变异共用引物探针的其他变异是否验证充分等,来对该变异的临床性能进行评价。
临床意义的证据
对于有明确伴随诊断临床意义的基因变异,应明确所伴随的抗肿瘤药物,并提供相应的伴随证据。例如,对于作为与抗肿瘤药物共同开发的伴随诊断试剂,申请人可提供支持该药物上市的关键性药物临床试验数据作为试剂的伴随诊断证据。若申报产品为抗肿瘤上市后所开发的非原研伴随诊断试剂,申请人可通过与原研伴随诊断试剂进行一致性比对、桥接试验、回顾性药物疗效观察性研究等方式进行临床试验设计,提供伴随诊断证据。申请人可根据伴随诊断试剂相应的指导原则提交临床证据。
此外,对于二级位点,如境内尚无同类产品被批准,申请人则应提供相关诊疗指南等行业公认的支持性资料作为其临床意义的证据。
(作者单位:国家药监局医疗器械技术审评中心)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:谯英固)
分享至
右键点击另存二维码!
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有